3.3. Aminosäuren, Peptidbindung, Eiweiße
3.3.1. Einleitung. Neben den Kohlenhydraten und Fetten sind die Eiweißstoffe die Hauptbestandteile der menschlichen und tierischen Nahrung. Sie geben bei ihrer Oxydation nicht nur eine Energie von 4,1 cal (neue Bezeichnung ist Joul) je Gramm, sondern sind zugleich Bestandteile von Hormonen und Enzymen. Als Eiweißstoffe bezeichnet man hochmolekulare kolloide Naturprodukte, die sich aus einer großen Anzahl von a-Aminosäuren als Grundbausteinen zusammensetzen.Die a-Aminosäuren leiten sich von den Karbonsäuren ab, indem ein H-Atom am a-Kohlenstoffatom durch eine Aminogruppe -NH2 substituiert wird. Die einfachste Säure ist das Glyzin, das wie alle a-Aminosäuren in Betainstruktur vorliegt; dadurch wird der relativ hohe Schmelzpunkt der Aminosäuren bedingt. Außer Glyzin haben alle a-Aminosäuren ein asymmetrisches C-Atom und sind daher optisch aktiv; alle natürlichen Aminosäuren gehören der L-Reihe an. Die optisch aktiven a-Aminosäuren können als Gemisch der D- und L-Form entweder durch Umsetzung von Halogensäuren mit Ammoniak oder nach der Streckerschen Synthese aus Aldehyden durch Addition von Blausäure in Gegenwart von Ammoniak erhalten werden. Eine Trennung in D- und L-Form erfolgt durch Kristallisation mit einer optisch aktiven Base.
Das charakteristische Merkmal der Eiweiße oder Peptide ist die Laktam- oder Säureamidgruppierung -CO-NH- an der Verknüpfungsstelle zweier Aminosäuren. Eine derartige Verknüpfung wird auch als Peptidbindung bezeichnet. Synthetisch kann eine Peptidverbindung dadurch geknüpft werden, daß das Hydrochlorid eines Aminosäurechlorids mit einem Aminosäureester zur Reaktion gebracht wird. Durch verschiedene Polypeptidsynthesen ist der Chemiker in der Lage, einzelne einfache Eiweiße zu synthetisieren. Das Hormon Insulin, das den Zuckerhaushalt reguliert und die spezifische Therapie der Zuckerkrankheit ermöglicht, ist das chemisch am besten untersuchte Protein. Es wird in den Langerhansschen Zellen der Bauchspeicheldrüse erzeugt. Das Insulin hat ein Molekulargewicht von rund 5700 und enthält 51 Aminosäuren, die sich auf zwei Polypeptidketten verteilen, die durch Disulfidbrücken zusammengehalten werden. Die Disulfidbrücken entstehen durch Oxydation des Zystein zu Zystin, die beide ein reversibles Redoxsystem bilden.
Synthetisch wurde Insulin erstmals 1963 von Zahn, Meienhofer und Schnabel hergestellt. Synthetisches Insulin ist keine Erfindung der Genforschung.
Es gibt 20 verschiedene Aminosäuren, aus denen sich sämtliche Proteine im menschlichen Organismus bilden. Zwölf davon kann der Organismus selbst bilden, sie heißen nichtessentielle Aminosäuren, weil sie durch die körpereigene Biosynthese ersetzbar sind. Die restlichen acht essentiellen (unentbehrlichen) Aminosäuren kann der Körper nicht selbst synthetisieren, sie müssen mit der Nahrung zugeführt werden.
3.3.2. Minimalbedarf (g/d) an für den Menschen essentiellen Aminosäuren; die empfohlene Tageszufuhr beträgt das
Doppelte.
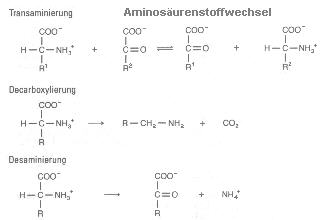
3.3.3. Aminosäurestoffwechsel; zusammenfassende Bezeichnung für Reaktionen des katabolen (abbauend) und anabolen (aufbauend) Umbaus von Aminosäuren. Die wichtigsten Formen: 1. Transaminierung (katalysierter Austausch); 2. Decarboxylierung: Biosynthese biogener Amine; 3. oxidative Desaminierung.
3.3.4. Essentielle Aminosäuren müssen dem Organismus täglich mit der Nahrung zugeführt werden. Anders als bei Hormonen und Enzymen ist der menschliche Organismus nicht in der Lage, sie selbst herzustellen. Aminosäuren sind die Grundlage für die Biosynthese der Eiweißverbindungen (Proteine, Peptide).
 3.3.4.1. Isoleucin; Abk. Ile, I; L-a-Amino-b
-methylpentansäure; proteinogene, essentielle, aliphat. und neutrale Aminosäure; gluko- u. ketoplastisch;
Anwendung zur parenteralen Ernährung.
3.3.4.1. Isoleucin; Abk. Ile, I; L-a-Amino-b
-methylpentansäure; proteinogene, essentielle, aliphat. und neutrale Aminosäure; gluko- u. ketoplastisch;
Anwendung zur parenteralen Ernährung.
3.3.4.2. Leucin; Abk. Leu, L; a-Aminoisocapronsäure, L-2-Amino-4-methylpentansäure; essentielle, proteinogene, neutrale Aminosäure. Vorkommen der D-Form in Peptidantibiotika; Anwendung als Lebertherapeutikum.
3.3.4.3. Lysin; Abk. Lys, K; basische essentielle Aminosäure; Vorkommen in den meisten tierischen (Myosin, Kollagen, Histone), weniger in pflanzlichen Proteinen; Decarboxylierung ergibt Cadaverin (Eiweißfäulnis, Leichengift); Abbau in der Leber über Pipecolinsäure zu Acetoacetyl-CoA bzw. Acetyl-CoA.
3.3.4.4. Methionin; Abk. Met, M; a-Amino-g
-methyl-mercaptobuttersäure; essentielle schwefelhaltige proteinogene Aminosäure, aus der durch Reaktion mit ATP
(Phosphatverbindung) der Methylgruppendonor Adenosylmethionin entsteht; Tagesbedarf: 1-2 g; mit bakteriostatischer Wirkung;
Verwendung bei Harnwegentzündung und chron. Nierenminderleistung. Bei Resorptionsstörungen im Darm: Geistige
Behinderung, Krämpfe, stinkende Durchfälle, weiße Haare.
3.3.4.5. Phenylalanin; Abk. Phe, F; L-a-Amino-b -phenyl-propionsäure; essentielle, proteinogene, aromatische Aminosäure; Abbau über Tyrosin* u. Fumarsäure zu Acetessigsäure.
3.3.4.6. Threonin; Abk. Thr, T; L-threo-a-Amino-b -hydroxybuttersäure, (2S, 3R)-2-Aminohydroxybutansäure; essentielle proteinogene Aminosäure mit zwei asymmetrischen C-Atomen; Abbau zu CoA-aktiver Propionsäure oder zu Glycin und Acetaldehyd.
3.3.4.7. Tryptophan; Abk. Trp, W; essentielle, proteinogene, aromatische Aminosäure; Ausgangssubstanz für die
Biosynthese von Serotonin*, Melatonin*, Nicotinsäure*; Abbau durch Kynureninase (abhängig von Pyridoxalphosphat, Vitamin B6);
bakterieller Abbau (Darinflora) zu Tryptamin, Skatol u. Indol (Eiweißfäulnis); Resorptionsstörung bei
Hartnup-Krankheit.
Verwendung zur Aminosäuresubstitution, als Antidepressivum und Schlafmittel;
Tryptamin; biogenes Amin, das durch Decarboxylierung aus Tryptophan entsteht; stimuliert die Kontraktion (Blutdurchfluß) der glatten Gefäß- und Uterusmuskulatur. Tryptamin ist auch bakteriologisches Abbauprodukt und kann zu Serotonin* hydroxyliert werden.
3.3.4.8. Valin, Abk. Val, V; essentielle Aminosäure; Vorkommen in fast allen Proteinen; Abbau über CoA-aktivierte Metylmalonsäure zu Succynil-CoA.
Metylmalonsäure in aktiver Form ein CoA. Zwischenprodukt beim Abbau von Methionin*, Isoleucin*, Valin* und ungeradzahliger Fettsäuren. Erhöhe Konzentration bei Blutanämien; abhängig von Cobalamin*
3.3.5. nichtessentielle Aminosäuren Histidin, Arginin und Tyrosin sind essentiell für Säuglinge, abhängig von der Phenylalanin-Zufuhr.
3.3.5.1. Histidin; Abk. His, H; Imidazolylalanin, 2-Amino-3-(4-imidazolyl)propansäure; proteinogene, z. T. essentielle
Aminosäure. Vorkommen besonders reichlich in Hämoglobin; als 3-Methylhistidin in Aktin u. Myosin (Muskelproteine,
Kontraktion); Decarboxylierung ergibt Histamin.
Histamin; durch Histidindecarboxylase aus Histidin gebildetes biogenes Amin; Gewebehormon, Neurotransmitter*; Vorkommen in
den Mastzellen (Blut), in geringer Menge in Thrombo- und Leukozyten; in Neuronen des hinteren Hypothalamus; Freisetzung durch
endogene u. exogene Histaminliberatoren, z. B. IgE (Immunreaktion), Verbrennung und Entzündung. Abbau in Niere und Gehirn, Magen und
Darm, durch Darmbakterien).
Wirkungen über Rezeptoren: Kontraktion glatter Musulatur in Darm, Uterus, Bronchien, großen Gefäßen,
Dilatation kleiner Gefäße, Hautrötung Quaddelbildung), Adrenalinausschüttung, Schmerzen Juckreiz durch Wirkung auf
sensible Nervenenden.
3.3.5.2. Arginin; Abk. Arg, R; a-Amino-d -guanidinovaleriansäure, 2-Amino-5-guanidinopentansäure; stark basische, proteinogene und glukogene Aminosäure; Zwischenprodukt im Harnstoffzyk-lus; Ausgangsstoff der Biosynthese von Stickstoffmonoxid (NO); beteiligt an Biosynthese: Antioxidanzie, Muskelentspannung, Neurotransmitter.
3.3.5.3. Tyrosin; Abk. Tyr, Y; aromatische., ketogene und proteinogene Aminosäure; entsteht durch Hydroxylierung von
Phenylalanin* und ist Vorstufe der Biosynthese von Dopamin*, Adrenalin*, Thyroxin* und der Melanine*. Abbau durch Tyrosintransaminase
zu 4-Hydroxyphenylbrenztraubensäure und über Homogentisinsäure zu Maleylacetoacetat; Abbau i. R. der
Eiweißfäulnis zu Kresol und Phenol; Anwendung bei Schilddrüsenerkrankungen.
Die Hormone (Adrenalin, Dopamin, Thyroxin, Melatonin) haben Einfluß auf mentale Vorgänge im Hirnstoffwechsel
(Demenz, Parkinson, Depressionen usw.).
3.3.5.4. Glycin; Abk. Gly, G; Aminoessigsäure; einfachste und ein-zige nicht optisch aktive proteinogene Aminosäure; süßer Geschmack. Vorkommen z. B. in Hippursäure, Glutathion- und Glykocholsäuren. Glycin fungiert als hemmender Neurotransmitter* in Rückenmark und Hirnstamm (Kontrolle der Motorik) u. als Koppelung für Rezeptoren.
3.3.5.5. Alanin; Abk. Ala, A; a-Aminopropionssäure, 2-Aminopro-pansäure; proteinogene Aminosäure. Bildet Enzyme, die als Katalysatoren wirken. Erhöhte Werte bei Leberproblemen.
3.3.5.6. Serin; Abk. Ser, S; L-a-Amino-b -hydroxypropionsäure; proteinogene und glukogene Aminosäure; Serin wird u. a. zur Biosynthese von Sphingosin, Colamin, Cholin und der Kephaline (Zwischenprodukte, z.B. Cholinmangel führt zur Fettleber) benötigt; Abbau zu Pyruvat (Salz) oder Umbau zu Glycin.
3.3.5.7. Asparaginisäure; Abk. Asp, D; a-Aminobernsteinsäure, 2-Aminobutandisäure; saure proteinogene Aminosäure; Aminogruppendonor bei Transaminierung wichtig im Harnstoffzyklus und zur Biosynthese der Purin- und Pyrimi-dinbasen).
3.3.5.8. Asparagin; Abk. Asn od. Asp(NH2), N; 2-Aminobernsteinsäure-4-amid; proteinogene Aminosäure, Semiamid der Asparaginsäure; freies Aspargin kommt z. B. im Spargel vor.
3.3.5.9. Glutaminsäure; Abk. Glu, E; a-Aminoglutarsäure, 2-Aminopentandisäure; proteinogene Aminosäure, die biosynthetisch durch Transaminierung aus Alphaketoglutarsäure entsteht; Synthese v. a. in Leber, Niere, Gehirn und Lunge; Abbau im Gitratzyklus nach Transaminierung zu Alphaketoglutarsäure oder Decarboxylierung zu 4-Aminobuttersäure, die weiter zu Bernsteinsäure umgesetzt wird. Bedeutung: Vorstufe der Biosynthesen von GABA, Ornithin, Prolin, Hydroxyprolin; Baustein der Folsäure; Neurotransmitter; als Natriummonoglutamat Geschmacksverstärker in der Lebensmittelindustrie (China-Restaurant-Syndrom).
3.3.5.10. Glutamin; Abk. Gin od. Glu(NH2), Q; 2-Aminoglutarsäure-5-amid; proteinogene Aminosäure, Amid der Glutaminsäure; zentraler Metabolit im Stickstoffmetabolismus der Pflanzen und Tiere; Aminogruppendonor bei vielen biochemischen Reaktionen (z. B. Transaminierung, Purin-, Tryptophan-, Glukosaminsynthese); die Glutaminsynthetase katalysiert die Amidbildung aus Glutaminsäure und NH4+ unter ATP-Verbrauch (Enzym) und dient damit v. a. in der Muskulatur der Ammoniakentgiftung.
3.3.5.11. Cystein; Abk. Cys, C; -a Amino-b
-mercaptopropionsäure, 2-Amino-3-mereaptopropansäure; proteinogene Aminosäure; zentrale Verbindung im Schwefelstoffwechsel;
für Disulfidbindung in Proteinen verantwortlich; Oxidation zu Cystin. therap. Anw.: als Bestandteil von
Infusionslösungen, zur Proph. von Strahlenschäden; s. Aminosäuren.
Cystin; durch Oxidation der SH-Gruppe von Cystein entstandenes Disulfid; Vorkommen in vielen Proteinen, besonders in Keratinen.
3.3.5.12. Prolin; Abk. Pro, P; Pyrrolidin-2-carbonsäure; einzige proteinogene Aminosäure mit sekundärer Aminogruppe; glukoplastisch; als nicht helixbildende Aminosäure besondere Bedeutung bei der Ausbildung der Tertiärstuktur der Peptide; Biosynthese aus Glutaminsäure* oder aus exogen zugeführtem Ornithin; Vorkommen. besonders in Kollagen* (zus. mit Hydroxyprolin).
Bruno Rupkalwis
Internet: www.hirndefekte.de